#IntesaScienceNews: Carbonio, superato il limite dei quattro legami
Una molecola originariamente proposta più di 40 anni fa sconvolge le regole relative al modo con cui l’atomo di carbonio si lega agli altri atomi. In questo insolito caso, un atomo di carbonio si lega ad altri sei atomi di carbonio. Questa struttura, schematizzata per la prima volta usando i raggi X, è un’eccezione al limite dei quattro possibili legami. Ciò è stato riportato dai ricercatori nella famosa rivista Angewandte Chemie.
Il Carbonio può superare il limite dei quattro legami:
Anche se l’idea per tale struttura non è nuova, “penso che essa abbia un maggiore impatto quando qualcuno possa vedere una immagine della molecola” afferma Dean Tantillo, un chimico dell’Università della California. “È molto importante che la gente capisca che, anche se ci viene insegnato che l’atomo di carbonio può formare al massimo solo quattro legami, il carbonio può essere associato a più di quattro atomi.”
Gli atomi si legano condividendo gli elettroni. In un tipico legame sono condivisi due elettroni, uno per ogni atomo coinvolto. Il carbonio, avendo quattro elettroni condivisibili, tende a formare quattro legami con altri atomi.
Tuttavia questa regola non sempre vale. Negli anni ’70, alcuni scienziati tedeschi fecero una insolita scoperta relativa a una molecola chiamata esametilbenzene. Tale molecola ha un anello esagonale planare composto da sei atomi di carbonio ognuno dei quali è legato un gruppo metilico –CH3. Gli elettroni rimanenti si dispongono al centro dell’anello rafforzando i legami e rendendo la molecola più stabile.
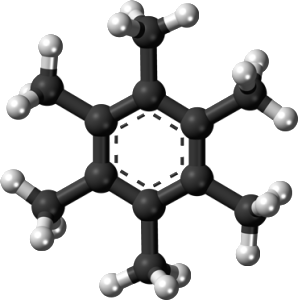
Quando gli scienziati hanno rimosso due elettroni dalla molecola, lasciandola con carica positiva, l’evidenza suggeriva che essa poteva drasticamente cambiare la sua forma. Sembrava che si riorganizzasse in modo tale che un atomo di carbonio fosse legato ad altri sei atomi di carbonio. Ma gli scienziati non hanno confermato sperimentalmente questa struttura.
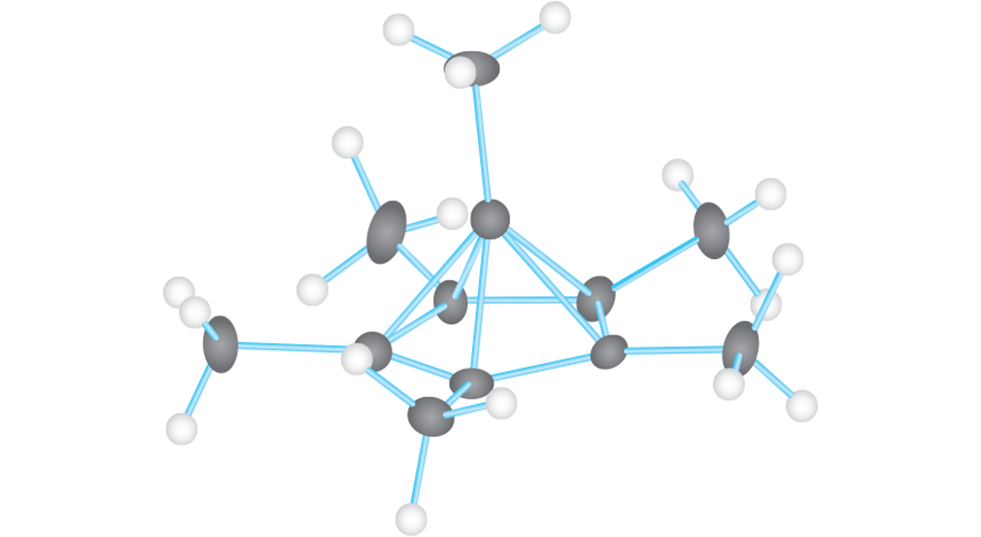
Ora, un diverso laboratorio ha rivisto tale questione. “Realizzare questa versione carica di esametilbenzene è una sfida in quanto risulta stabile solo in un acido estremamente forte” dice Moritz Malischewski, coautore di questo studio e chimico alla Free University di Berlino. Inoltre i precedenti dettagli riguardanti tale esperimento non erano molto chiari. Tuttavia, dopo alcune modifiche, riuscì a creare la molecola carica. Egli e il coautore Konrad Seppelt concretizzarono ciò con altre molecole e successivamente usarono i raggi X per ottenere uno schema tridimensionale della struttura cristallina.
L’esperimento ai raggi X confermò ciò che gli altri scienziati avevano suggerito negli anni ’70: quando l’esametilbenzene perdeva due elettroni, si dava un nuovo ordine. Un atomo di carbonio era saltato fuori dall’anello e aveva preso una nuova posizione in alto modificando il planare anello esagonale in una piramide a cinque facce. L’atomo in cima alla piramide si era, invece, legato ad altri sei atomi di carbonio (cinque nell’anello sottostante e uno sopra).
“Questa molecola è eccezionale” afferma Malischewski. Anche se gli scienziati hanno scoperto altre eccezioni alla formazione dei quattro possibili legami del carbonio, questa è la prima volta che il carbonio viene mostrato in associazione con altri atomi di carbonio.
Quando Malischewski misurò la lunghezza dei legami chimici della molecola, ognuno dei sei legami del carbonio in alto era un poco più lungo di un normale legame C-C. Un legame più lungo è generalmente meno forte. Quindi, scegliendo più partner, quel carbonio ha una connessione leggermente più debole rispetto a un normale atomo di carbonio.
“L’atomo di carbonio non sta facendo sei legami nel senso che di solito si pensa a un legame carbonio-carbonio come un legame a due elettroni” dice Tantillo. Questo perché l’atomo di carbonio ha ancora solo quattro elettroni da condividere. Di conseguenza, esso si espande limitatamente condividendo elettroni tra i sei legami.
Articolo e traduzione a cura di Flavia Bonfiglio
Vi aspettiamo al prossimo articolo ….
Per saperne di più: https://www.sciencenews.org/article/carbon-can-exceed-four-bond-limit

