#IntesaScienceNews: Xofluza, approvato dall’FDA il primo farmaco monodose per il trattamento dell’influenza.
Roche annuncia l’approvazione da parte della FDA di Xofluza (baloxavir marboxil) per l’influenza.
Primo e unico farmaco orale monodose approvato per il trattamento dell’influenza, Xofluza ha ridotto significativamente la durata dei sintomi influenzali rispetto al placebo. Risulta al momento il primo meccanismo d’azione proposto, per curare l’influenza, in quasi 20 anni.
La casa farmaceutica giapponese Shionogi ha messo a punto Baloxavir Marboxil, farmaco in grado di eliminare il virus che causa l’influenza nel giro di 24 ore assumendo una sola dose. I più potenti farmaci attualmente in circolazione per eliminare il virus impiegano, invece, 72 ore ed è necessario assumere all’incirca 10 dosi affinchè agiscano nella maniera desiderata sull’organismo.
L’annuale depotenziamento dei vaccini (dovuto alla rapida evoluzione dei ceppi virali) e l’emergente resistenza ai farmaci a disposizione ci costringe a sviluppare inibitori supplementari che agiscano sulle proteine del virus più conservate (e che quindi tenderanno ad evolversi più lentamente). Ovviamente sarebbero preferibili delle piccole molecole assumibili oralmente e non costosissimi farmaci biotecnologici da assumere per via parenterale.
Nel corso dell’ultimo decennio numerosi sforzi sono stati fatti per sviluppare farmaci di questo tipo e si è trattato di sforzi che hanno già dato i loro frutti: pensate al Tamiflu (oseltamir), commercializzato da Roche, la stessa Roche che oggi ha annunciato l’approvazione da FDA del baloxavir marboxil (nome commerciale: Xofluza) per il trattamento acuto dell’influenza.
Baloxavir Marboxil ha un meccanismo alternativo rispetto agli altri antivirali in commercio: esso è, infatti, un inibitore dell’endonucleosi a differenza dell’oseltamivir (Tamiflu) e lo zanamivir (Relenza) che inibiscono l’azione della neuraminidasi (quella che muta di anno in anno e costringe la popolazione a ricorrere a nuovi vaccini), fondamentale per liberare i virus dalla superficie delle cellule infettate e permettergli di diffondere poi su altre cellule. Il Baloxavir può prevenire dunque la replicazione inibendo l’attività di una endonucleasi virale dipendente dalla polimerasi virale, la quale taglia RNA dell’ospite e sostituisce frammenti interni in un processo chiamato cap snatching attraverso cui i virus dirottano il sistema di trascrizione dell’mRNA dell’ospite per consentire la sintesi degli RNA virali e di conseguenza i vari componenti. In poche parole l’antivirale della Shionogi agisce bloccando sul nascere l’azione del virus dell’influenza impedendole di prendere il controllo delle cellule polmonari. 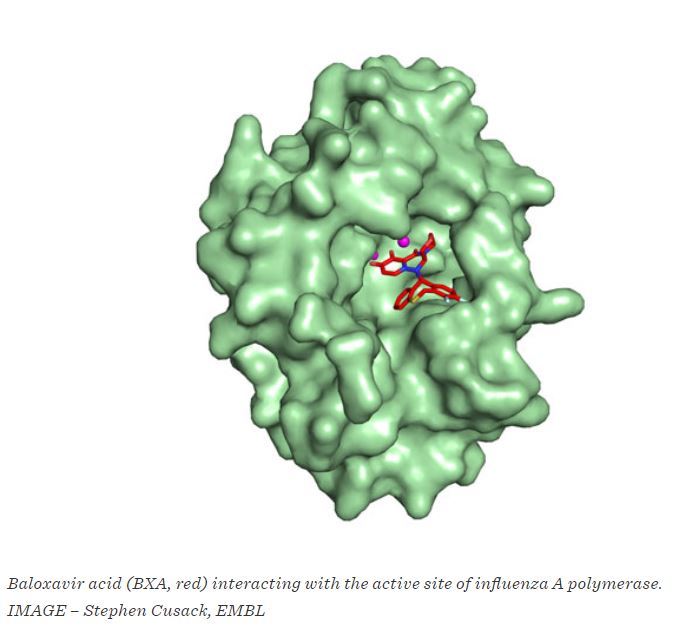
Xofluza si è dimostrato efficace contro un grande spettro di virus dell’influenza, inclusi i ceppi resistenti all’oseltamivir e quelli aviari (H7N9, H5N1) in studi non-clinici.
“Se i pazienti assumono il farmaco entro le 48 ore dall’inizio dei sintomi, una dose di Xofluza potrà ridurre significativamente la durata della malattia e dei sintomi annessi.”
Asserisce Sandra Horning, direttore medico operativo della Roche e capo del Global Product Development.
Xofluza è stato approvato a seguito di uno studio di fase III chiamato CAPSTONE-1, che ha confrontato l’efficacia del baloxavir (monodose) alla somministrazione di oseltamivir 75 mg (due volte al giorno per cinque giorni, come da terapia standard), su persone comunemente sane ma in momentaneo stato di influenza. A sua volta questo studio ne seguiva un altro di fase II che confrontava, nelle stesse condizioni, baloxavir con un placebo. Xofluza ha dimostrato una efficacia comparabile a quella di oseltamivir (ma, lo ribadiamo, con una singola somministrazione) ed effetti collaterali comparabili a quelli del placebo (quindi un’eccezionale sicurezza ed una buona tolleranza).
Approvato per la vendita in Giappone il 23 febbraio 2018, il 24 ottobre 2018, la FDA statunitense lo ha approvato per il trattamento dell’influenza acuta. Sul nostro mercato, invece, arriverà verosimilmente il prossimo anno, nel 2019.
Per ulteriori approfondimenti:
- Roche announces FDA approval of Xofluza (baloxavir marboxil) for influenza
- PubMed
- Flu’s response to new drug explored
Articolo a cura di: Emilio Greco


